延胡索酸是天然地在水果和蔬菜中发现的。它也被人工地制造出来用作一种食品添加剂,起着一种酸度调节剂和调味剂的作用。在三羧酸循环期间,它通常作为一种中间产物,被细胞用来产生能量。
遗传性平滑肌瘤病肾细胞癌(hereditary leiomyomatosis and renal cell cancer, HLRC)是一种罕见的癌症,导致皮肤瘤,并且能够导致肾癌。已知这种疾病与编码延胡索酸水合酶(fumarate hydratase, FH)的基因发生的一种突变相关联,但是在此之前,人们仍不清楚这如何导致肿瘤生长。FH是在线粒体中发现的。
在这项新的研究中,研究人员将RNA测序与代谢组学---研究代谢时产生的小分子---结合在一起,发现是什么导致肿瘤生长。
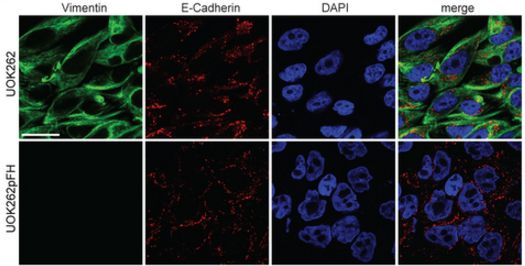
研究人员发现由于FH缺失所产生的过量的延胡索酸导致一种被称作miR-200的微RNA(microRNA)发生表观遗传变化。这导致miR-200受到抑制,其中miR-200发挥着阻止癌细胞转移的功能。
这些表观遗传变化导致启动上皮-间质转化(Epithelial to mesenchymal transition, EMT)的基因表达。这是正常的细胞发生癌变和转移而在全身扩散的过程。
如今鉴于与FH缺失相关的肿瘤生长机制是已知的,未来的研究将着重关注延胡索酸如何参与其他癌症。比如,已知FH在其他类型的癌症---包括非遗传性肾癌、神经母细胞瘤和肾上腺瘤---中是缺失的。鉴于癌细胞转移是癌症病人死亡的主要病因,理解如何阻断延胡索酸导致的癌细胞转移可能是开发癌症疗法的一种关键策略。未来也需要开展的研究是进一步理解延胡索酸在正常条件下的作用。
论文通信作者Christian Frezza博士说,“我们的研究发现提示着破坏FH和由此导致的延胡索酸积累在这种类型的肾癌中发挥着作用。这可能也是其他肿瘤类型---已报道也发生FH缺失,包括神经母细胞瘤、结直肠癌和肺癌---的一个特征。”
MRC分子与细胞医学主任Nathan Richardson博士(未参与这项研究)说,“这项研究的结果让我们更加清楚地认识延胡索酸如何参与这种类型的肾癌。它如今让我们有机会观察这是否也适用于其他常见的癌症类型,以及代谢如何与这种疾病的发展相关联。”(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷app。
Fumarate is an epigenetic modifier that elicits epithelial-to-mesenchymal transition
Marco Sciacovelli, Emanuel Gonçalves, Timothy Isaac Johnson, Vincent Roberto Zecchini, Ana Sofia Henriques da Costa, Edoardo Gaude, Alizee Vercauteren Drubbel, Sebastian Julian Theobald, Sandra Riekje Abbo, Maxine Gia Binh Tran, Vinothini Rajeeve, Simone Cardaci, Sarah Foster, Haiyang Yun, Pedro Cutillas, Anne Warren, Vincent Gnanapragasam, Eyal Gottlieb, Kristian Franze, Brian Huntly, Eamonn Richard Maher, Patrick Henry Maxwell, Julio Saez-Rodriguez & Christian Frezza
doi:10.1038/nature19353
PMC:
PMID:
Mutations of the tricarboxylic acid cycle enzyme fumarate hydratase cause hereditary leiomyomatosis and renal cell cancer1. Fumarate hydratase-deficient renal cancers are highly aggressive and metastasize even when small, leading to a very poor clinical outcome2. Fumarate, a small molecule metabolite that accumulates in fumarate hydratase-deficient cells, plays a key role in cell transformation, making it a bona fide oncometabolite3. Fumarate has been shown to inhibit α-ketoglutarate-dependent dioxygenases that are involved in DNA and histone demethylation4, 5. However, the link between fumarate accumulation, epigenetic changes, and tumorigenesis is unclear. Here we show that loss of fumarate hydratase and the subsequent accumulation of fumarate in mouse and human cells elicits an epithelial-to-mesenchymal-transition (EMT), a phenotypic switch associated with cancer initiation, invasion, and metastasis6. We demonstrate that fumarate inhibits Tet-mediated demethylation of a regulatory region of the antimetastatic miRNA cluster6 mir-200ba429, leading to the expression of EMT-related transcription factors and enhanced migratory properties. These epigenetic and phenotypic changes are recapitulated by the incubation of fumarate hydratase-proficient cells with cell-permeable fumarate. Loss of fumarate hydratase is associated with suppression of miR-200 and the EMT signature in renal cancer and is associated with poor clinical outcome. These results imply that loss of fumarate hydratase and fumarate accumulation contribute to the aggressive features of fumarate hydratase-deficient tumours.
相关会议推荐

2016 下一代CAR&TCR-T研讨会
会议时间:2016.10.21-2016.10.22 会议地点:上海