这些发现通过提供对这种在传递疼痛信号中起着关键性作用的ASIC的运行机制更加精确的理解,有望对着重关注开发控制疼痛的治疗试剂的进一步研究产生重大的影响。
当在有机体内分布的痛点被刺激时,疼痛便通过痛觉神经(nociceptive nerve)进行传播。准确地说,当导致疼痛的物质与组成痛点的细胞的质膜(即细胞膜)结合在一起时,疼痛信号就被识别出。
在有机体内,pH水平变化在病理生理学条件---如炎症、局部缺血和癌症等等,都伴随着疼痛---下发生。ASIC检测有机体中的pH水平变化,传递疼痛信号到大脑中。在生物学上,针对ASIC以开展过很多研究;然而,很多方面仍然是未知的,特别是ASIC的运行机制和细胞膜融合机制。
Suh团队在分子水平上检测了调节ASIC活性的细胞膜融合机制,从而鉴定出ASIC的新的细胞膜融合机制,而在此之前,这种机制一直是未知的。
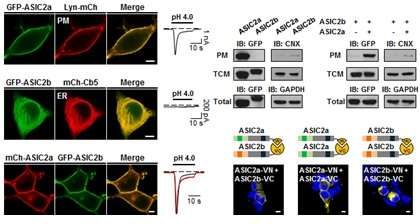
Suh团队通过开展动物实验而鉴定出这种细胞膜融合机制,其中在动物体内,在ASIC的亚基之间存在一种不同的细胞膜融合机制。作为ASIC的一种亚基,ASIC2a能够与细胞膜融合在一起,而且具有一种细胞膜融合信号,与此相反的是,另一种ASIC亚基,ASIC2b,不能够与细胞膜融合在一起。此外,ASIC2b也没有细胞膜融合信号,仅仅能够通过与ASIC2a形成一种异源蛋白复合体而融合到细胞膜上。
这项研究的结果是有意义的,这是因为它鉴定出ASIC的一种新的细胞膜融合机制,再者,它也是非常重大的,这是因为它为理解多种离子通道---包括ASIC2、ASIC2b和很多其他的亚基---的活性控制机制提出新的研究方向。
Suh说,“理解ASIC的这种细胞膜融合和活性控制机制在鉴定疼痛信号传递系统中发挥着重要的作用。我们的研究鉴定出的ASIC的这种新的控制机制具有重要的意义。通过持续的研究,我将努力鉴定出作用于这种神经系统中的其他运行机制和开发治疗疼痛的新方法。”(生物谷 Bioon.com)
本文系生物谷原创编译整理,欢迎转载!点击 获取授权 。更多资讯请下载生物谷app。
Acid-Sensing Ion Channel 2a (ASIC2a) Promotes Surface Trafficking of ASIC2b via Heteromeric Assembly
Hae-Jin Kweon, Dong-Il Kim, Yeonju Bae, Jae-Yong Park & Byung-Chang Suh
doi:10.1038/srep30684
PMC:
PMID:
Acid-sensing ion channels (ASICs) are proton-activated cation channels that play important roles as typical proton sensors during pathophysiological conditions and normal synaptic activities. Among the ASIC subunits, ASIC2a and ASIC2b are alternative splicing products from the same gene, ACCN1. It has been shown that ASIC2 isoforms have differential subcellular distribution: ASIC2a targets the cell surface by itself, while ASIC2b resides in the ER. However, the underlying mechanism for this differential subcellular localization remained to be further elucidated. By constructing ASIC2 chimeras, we found that the first transmembrane (TM1) domain and the proximal post-TM1 domain (17 amino acids) of ASIC2a are critical for membrane targeting of the proteins. We also observed that replacement of corresponding residues in ASIC2b by those of ASIC2a conferred proton-sensitivity as well as surface expression to ASIC2b. We finally confirmed that ASIC2b is delivered to the cell surface from the ER by forming heteromers with ASIC2a, and that the N-terminal region of ASIC2a is additionally required for the ASIC2a-dependent membrane targeting of ASIC2b. Together, our study supports an important role of ASIC2a in membrane targeting of ASIC2b.